第8章 沉淀溶解平衡


《第8章 沉淀溶解平衡》由会员分享,可在线阅读,更多相关《第8章 沉淀溶解平衡(37页珍藏版)》请在文档大全上搜索。
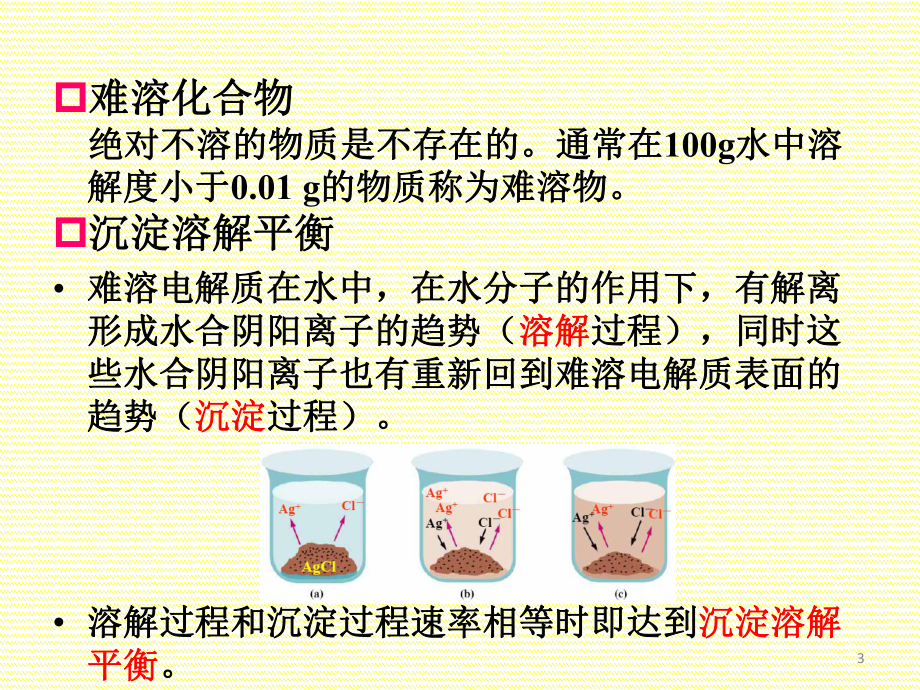
1、第第8章章 沉淀溶解平衡沉淀溶解平衡14.1 难溶化合物的溶度积难溶化合物的溶度积 什么是难溶化合物?通常区分难溶物的标什么是难溶化合物?通常区分难溶物的标准是什么?准是什么? 什么是沉淀溶解平衡?什么是沉淀溶解平衡? 沉淀溶解平衡的常数称为什么?其表达式沉淀溶解平衡的常数称为什么?其表达式如何书写?如何书写? 沉淀溶解平衡常数有哪些特点?量纲如何?沉淀溶解平衡常数有哪些特点?量纲如何? 如何获得沉淀溶解平衡常数的数值?如何获得沉淀溶解平衡常数的数值?p难溶化合物难溶化合物 绝对不溶的物质是不存在的。通常在绝对不溶的物质是不存在的。通常在100g水中溶水中溶解度小于解度小于0.01 g的物质称
2、为难溶物。的物质称为难溶物。p沉淀溶解平衡沉淀溶解平衡 难溶电解质在水中,在水分子的作用下,有解离难溶电解质在水中,在水分子的作用下,有解离形成水合阴阳离子的趋势(形成水合阴阳离子的趋势(溶解溶解过程),同时这过程),同时这些水合阴阳离子也有重新回到难溶电解质表面的些水合阴阳离子也有重新回到难溶电解质表面的趋势(趋势(沉淀沉淀过程)。过程)。 溶解过程和沉淀过程速率相等时即达到溶解过程和沉淀过程速率相等时即达到沉淀溶解沉淀溶解平衡平衡。3p溶度积常数溶度积常数沉淀溶解平衡常数沉淀溶解平衡常数 Ksp 溶度积常数,简称溶度积。溶度积常数,简称溶度积。 Ksp具有标准平衡常数的特征,取决于难溶电解
3、具有标准平衡常数的特征,取决于难溶电解质的本性和温度。质的本性和温度。 Ksp反映了难溶电解质溶解能力。反映了难溶电解质溶解能力。 Ksp值可以通过查表得到值可以通过查表得到 (aq)mB(aq)nA (s)BAnmmn-+spnmrr(A B )AB mnnmK+- 什么是难溶电解质的溶解度?其量纲如何?什么是难溶电解质的溶解度?其量纲如何? 溶解度和溶度积的换算关系如何?溶解度和溶度积的换算关系如何? 如何用溶度积来比较难溶电解质的溶解度如何用溶度积来比较难溶电解质的溶解度大小?大小?p溶度积和溶解度的关系溶度积和溶解度的关系溶解度(溶解度(S/molL-1 ):一定温度下):一定温度下1
4、L难溶电解质难溶电解质饱和溶液中所含溶质的物质的量。饱和溶液中所含溶质的物质的量。对于难溶强电解质,不包含易水解的难溶电解质对于难溶强电解质,不包含易水解的难溶电解质和难溶弱电解质,有和难溶弱电解质,有nSmSA B (s) A(aq)B (aq)mnnmnm+-+sp()()nmKnSmS233spsp2,/4KSSKspsp,KS SSK44spsp27,/27KSSK6AB型型AB3或或A3B型型AB2或或A2B型型对同一类型难溶电解质可以用对同一类型难溶电解质可以用Ksp的大小来比较的大小来比较其其S的大小,的大小, Ksp越大,则越大,则S越大。越大。对于不同类型的难溶电解质,则不能
5、通过对于不同类型的难溶电解质,则不能通过Ksp直直接比较溶解度的大小,而是需要通过具体计算接比较溶解度的大小,而是需要通过具体计算S加以判断。加以判断。 7 例:比较室温下例:比较室温下AgCl和和Ag2CrO4的溶解度的溶解度 298K, Ksp(AgCl)1.7710-10, Ksp(Ag2CrO4)1.1210-12,51sp(AgCl)1.33 10 mol LScK-51324sp24 (Ag CrO )(Ag CrO )/46.54 10 mol LScK- 什么是难溶电解质的离子积,其与溶度积什么是难溶电解质的离子积,其与溶度积有何区别和联系?有何区别和联系? 什么是溶度积规则?
6、什么是溶度积规则?溶度积规则溶度积规则通过通过Q和和Ksp的比较,判断沉淀平的比较,判断沉淀平衡移动的方向。衡移动的方向。离子积离子积 Q:任意状态下,难溶电解质的溶液中离子任意状态下,难溶电解质的溶液中离子浓度的乘积浓度的乘积 Q Ksp,过饱和溶液,沉淀析出。,过饱和溶液,沉淀析出。p溶度积规则溶度积规则A B (s) A(aq)B (aq)mnnmnm+-+ (A )/)(B )/)nmmnQcccc+-9 影响沉淀溶解平衡的因素有哪些?影响沉淀溶解平衡的因素有哪些? 这些因素作用的机制如何?这些因素作用的机制如何?p影响沉淀溶解平衡的因素影响沉淀溶解平衡的因素 有三种重要因素影响沉淀溶
7、解平衡:同离子效有三种重要因素影响沉淀溶解平衡:同离子效应、盐效应、副反应应、盐效应、副反应(酸效应、配位效应等酸效应、配位效应等)a. 同离子效应同离子效应 在难溶电解质溶液中加入与其含有相同离子的易在难溶电解质溶液中加入与其含有相同离子的易溶强电解质,而使难溶电解质的溶解度降低的溶强电解质,而使难溶电解质的溶解度降低的作用。作用。b.盐效应盐效应 在难溶电解质溶液中,加入易溶强电解质而使难在难溶电解质溶液中,加入易溶强电解质而使难溶电解质的溶解度增大的作用。溶电解质的溶解度增大的作用。11例:求例:求 25时,时, Ag2CrO4在在 0.010 molL-1 K2CrO4溶液中溶液中的溶
8、解度。的溶解度。x.x cc+-+0100 2 ) L/(mol 0.010 0 )L/(mol (aq)CrO(aq)2Ag (s)CrOAg 1B1B2442平衡初始212sp61261451(2 )(0.010)1.1 10 0.0100.010 5.2 100.010mol L CrO 5.2 10 mol L 6.5 10 mol LxxKxxSS-+12未加入时未加入时例:例:AgCl在在KNO3溶液中的溶解度溶液中的溶解度 (25 )3151(KNO ) /(mol L ) /(AgCl) /10 (mol L ) cS- 0.00 0.00100 0.00500 0.0100
9、1.278 1.325 1.385 1.42713(1) 当当 时,时, 增大,增大, S(PbSO4)显著减小,同离子效应占主导显著减小,同离子效应占主导;124oL0.04mol)(SO-c)(SO24-c(2) 当当 时,时, 增大,增大, S(PbSO4)缓慢增大,缓慢增大,124oL0.04mol)(SO-c)(SO24-c 同离子效应和盐效应同时存在,以同离子效应为主,同离子效应和盐效应同时存在,以同离子效应为主,当外加电解质浓度较大,电荷较高及当外加电解质浓度较大,电荷较高及Ksp较大,须考较大,须考虑盐效应;虑盐效应;当溶液中各离子浓度不大或当溶液中各离子浓度不大或Ksp较小时
10、,较小时,不考虑盐效应。不考虑盐效应。 14c. 酸效应酸效应 若组成难溶电解质的阴离子是弱碱(如若组成难溶电解质的阴离子是弱碱(如CO32-) ,当溶液当溶液pH值降低,使平衡向正向移动,即沉淀的值降低,使平衡向正向移动,即沉淀的溶解度增大。溶解度增大。d. 配位效应配位效应 组成难溶电解质的离子若能形成配离子,也能使组成难溶电解质的离子若能形成配离子,也能使 溶解度比计算值大溶解度比计算值大-2AgCl(s)Ag (aq)Cl (aq) 2Cl (aq)=AgCl (aq)+-+154.2 沉淀的生成和溶解沉淀的生成和溶解p沉淀的生成沉淀的生成 条件:条件: 方法:加入沉淀剂方法:加入沉淀